小腹が空きました。
好物の「讃岐うどん」を食べました。
水は無味、無臭、常温常圧ではごくわずかに青緑色を呈す透明の液体である。水は、かつて1kgや1calの単位の基準として用いられた。(→#物理的性質)
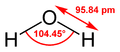
化学的には化学式 H2O で表され、水素原子と酸素原子は共有結合で結びついている。(→#化学的性質)
地球表面、特に海洋に豊富に存在する。生物の生存、日常生活をはじめ、工業や医療などに不可欠であり、人類にとって最も身近な物質である。この様に身近である水だが、宇宙全体から見ると液体の水として存在している量は少ない。(→#水の分布)
古代ギリシャではタレスが「万物のアルケーは水」とし、エンペドクレスは、4元素のひとつとして水を挙げた。(→#水についての考察・研究史)
すべての既知の生命体にとって、水は不可欠な物質である。生物体を構成する物質で、最も多くを占めるのが水である。核や細胞質で最も多い物質でもあり、細胞内の物質代謝の媒体としても使用されている。通常、質量にして生物体の70% - 80%が水によって占められている。人体も60%から70%程度が水である。(→#生物と水)
「水」の概念を自然科学的に拡張して、化学式で「H2O」と表現できるものをすべて広義の「水」とすれば、水の中でも固体のそれが氷、液体は(いわゆる日本語の)水、気体は水蒸気、ということになる。
英語やフランス語などでは、(液体であれば)温度にかかわらず、water、eauなど名称は一定である[1]。だが、日本語では、同じ液体でも温度によって名称を変えて呼び分ける。日本語では、温度が低温や常温のものは「水」と呼ぶが、温度が高くなると湯(ゆ)と言う[2]。
日常生活で人が用いるコップ1杯程度、あるいはバケツ、風呂程度の量の水はほとんど色は出ないので、水の色は「無色透明」と形容される。あるいは詩的な表現では、何かの色に染まっていないことの象徴として水が用いられることがある(ただし、これはメタファーであって、物理学的な言葉の使い方とは異なる)。しかし、海、湖、ダム、大きな川など、厚い層を成して存在する大量の水の色は青色に見える。このような状態で見える水の色を、日本語ではそのまま水色と呼んでいる。(→#物理的性質、水の青)
水の中でも、特に飲用に供するものを飲料水という。
現代の人類の水の使用量の約7割が農業用水である。現代の東京の家庭での水の使用量を多い順に並べると、トイレ、風呂、炊事となる。(→#水の使用)
物理的性質 [編集]
| 水 (H2O) | |
|---|---|
 |
 |
| 識別情報 | |
| CAS登録番号 | 7732-18-5 |
| RTECS番号 | ZC0110000 |
| 特性 | |
| 化学式 | H2O or HOH |
| モル質量 | 18.01528(33) g/mol |
| 外観 | 常温で僅かに青緑色を呈す透明の液体 |
| 密度 | 999.972 kg·m-3, 液体 (4℃) 916.8 kg·m-3, 固体 (0℃) |
| 融点 | |
| 沸点 |
100℃, 212 °F (373.15 K)[3] |
| 酸解離定数 pKa | 15.74 pKa2~35-36 |
| 塩基解離定数 pKb | 15.74 |
| 粘度 | 0.001 Pa·s at 20℃ |
| 構造 | |
| 結晶構造 | 六方晶系 |
| 分子の形 | 曲線状 |
| 双極子モーメント | 1.85 D |
| 熱化学 | |
| 標準生成熱 ΔfHo | -285.830 kJ mol-1(l) -241.818 kJ mol-1(g) |
| 標準モルエントロピー So | 69.91 J mol-1K-1(l) 188.825 J mol-1K-1(g) |
| 標準定圧モル比熱, Cpo | 75.291 J mol-1K-1(l) 33.577 J mol-1K-1(g) |
| 危険性 | |
| 主な危険性 | 水中毒, 水死 |
| NFPA 704 | |
| 関連する物質 | |
| 関連する溶媒 | アセトン メタノール |
| 関連物質 | 水蒸気 氷 重水 |
| 特記なき場合、データは常温(25 ℃)・常圧(100 kPa)におけるものである。 | |
常温、大気圧下で僅かに青緑色を呈す透明な液体。通常の1気圧での大気圧下の沸点は99.9839℃、融点は0℃である。しかし過冷却状態になる環境下では、99.9839℃以下の水蒸気も、0℃以下の水も存在する。3.98℃のとき最も密度が大きく、固体は液体より密度が小さい(通常気圧において、氷の密度は0.9168 である)。そのため固体である氷は液体の水に浮き、氷に圧力をかけると融ける。これは多くの他の分子とは異なる水の特性であり、氷の結晶構造が水分子間での水素結合により嵩高いものであることによるものである。液体の状態では 10−7 (mol/dm3) (25℃) が電離し、水素イオン(正確にはオキソニウムイオン)と水酸化物イオンとなっている。
水の色は一般に無色透明と言われる場合が多いが実際には水分子の赤外吸収スペクトルが可視領域に裾野を引き、赤色光を僅かに吸収する事からごく僅かな青緑色を呈す。海などの厚い層を成す水および巨大な氷が青いのもこのためである。
水は生活において大変手頃で重要な存在であったため、単位の基準として重要な役割を演じてきた。たとえば、水の融点と沸点とが0℃と100℃というきりのいい値であるのは、氷の融解温度と湯の沸騰温度を基準として摂氏の目盛りを定義したためであり、1g(グラム)の定義は4℃のときの1cm3の水の質量であり、1cal(カロリー)の定義は1gの水を1℃(1K の温度差)上げるのに必要な熱量であった。
しかし、水に質量の基準として高い精度を要求するとなると、必然的に高純度の水、高精度の体積、圧力、温度が要求されることになり、これらはいずれも技術的に難しくて面倒なため[4]、現在の質量の定義は1870年代に作成された国際キログラム原器を1キログラムとする本末転倒の基準になっている(キログラムを参照)。このため現在は4℃のときの1cm3の水の質量が0.999972gとなり、本来の1gではなくなってしまった[5]。また、従来は密度 (g/cm3) と比重が完全に一致していたが、この定義を境に一致しなくなった。
近年においてはカロリーがJ(ジュール)に置き換えられつつあり、このため水を使って定められる基準としては、一意に求めることができる水の三重点の熱力学温度を1/273.16 倍して得られる熱力学温度の単位 K(ケルビン)だけになった。しかし、日常生活においては高い精度が問題にされないため、(温度や純度をあまり気にせず)水1cm3が1gとして便利に使われたり、比重が1よりも大きい物質は水に沈み、1よりも小さい物質は水に浮くなど、生活に密着した基準として水は依然重要なままである。
前述の通り、水は液体の方が固体よりも体積が小さい異常液体の1種としても知られる。氷が融解して水になると、その体積は約11分の1減少する。詳細については氷の項も参照。
水は比熱容量が非常に大きいことでも知られる。反磁性の性質を示す代表的な物質でもあり、強力な磁石を近づけると水が反発して逃れるように動く現象は、旧約聖書の逸話にちなみ「モーゼ効果」と呼ばれている(俗称ではなく正式な学術用語)。
また、水分子の回転のエネルギー準位がマイクロ波のエネルギーに対応するため、水はマイクロ波を吸収しやすく、電子レンジはそれを利用して加熱をしている。
天然の水には、僅かに重水が含まれている。その大部分がHDO分子である。
一般的に水は電気絶縁性が低いと言われるが、これはイオンなどの不純物が含まれる通常の水の性質である。純粋な水は電気(電流)をほとんど通さない絶縁体である(自己解離により僅かに通す6.40×10−8Ω−1 cm−1 (25℃))。このため超純水の純度測定に電気伝導度を用いることがある。
亜臨界水・超臨界水 [編集]
水は22.12MPaの圧力をかけると374.15℃ (647.30K) まで液体の状態を保つ。これを亜臨界水という。これ以上の圧力、温度の状態の水を超臨界水という。その性質は通常の状態と異なりイオン積が高く通常の水よりオキソニウムイオンおよび水酸化物イオンの濃度が高くなる。また比誘電率が低い。その性質を利用するため研究されている。
過冷却水 [編集]
融点(1気圧では0℃)以下でも凍っていない、過冷却状態の液体の水のこと。不安定であり、振動などの物理的ショックにより結晶化を開始して氷に転移する。過冷却水の入っている容器にビー玉などを落とすと、物体が底に着く前に着水点から凍結が広がり、全体がシャーベット状に凍りつく。特別な実験装置などは必要なく、家庭の冷凍庫でも実験可能。ペットボトル等の容器に水(不純物のないものが望ましい)を入れ、マイナス5℃ - マイナス10℃ほどの温度を維持して冷却する。急激に冷やさず時間をかけること、振動を与えずに水全体が均一に冷やされる状況を作り出す(保冷剤やタオル等で包むなど)ことが成功のカギ。
アモルファス氷 [編集]
非結晶の氷のこと。通常の氷は結晶であるが、液体からの急冷、結晶氷を加圧、あるいは気相からの蒸着などの方法により、非結晶の氷が生成される。密度の違う2つの状態が存在し、それぞれ、高密度アモルファス氷、低密度アモルファス氷という[6]。
化学的性質 [編集]
化学的には化学式 H2O で表される。水分子の酸素原子と水素原子は共有結合で結びついており、その結合は水素原子と酸素原子から価電子を1つずつ供給されてできている。さらに酸素原子の最外殻には共有結合に使われていない孤立電子対が2つ存在する。水素と酸素の電気陰性度の違いから、O-H 結合においては酸素原子側が電気的に負、水素原子側が正となり、局所的に電気双極子を作っている。分子全体でも H-O-H 結合角が曲がっていることから極性を持つ。以上の理由から水の比誘電率は 79.87 (20℃) と高い。このためイオン間の静電気力を弱め塩化ナトリウムなどのイオン結晶の結合格子を破壊して溶解させる、すぐれた溶媒として働く。複数の水分子の間では水素原子と酸素原子の間に水素結合を作る。水に限らず、最外殻に孤立電子対を持つ窒素や酸素やフッ素などの原子やイオン、あるいは電気陰性度が高い原子に結合している水素原子は水分子と水素結合を作ることができる。したがって水は、糖などイオン性ではない分子に対する溶解性も示す。一方、シクロヘキサンなどの炭化水素はイオン性でなく、水素結合も形成しないため、水には溶解せずに寄り集まって油滴を作る。このように水に溶けない疎水性の化合物同士が水の中で見かけ上親和性を示す現象を疎水効果と呼ぶ。
複数の水分子の間に水素結合が働くことで、クラスター状の高次構造(水クラスター)が生じる。水の高次構造は寿命がピコ秒からフェムト秒オーダーと非常に短く、一度形成してもすぐ別の高次構造に移り変わる。
水分子は水素イオン (H+) の供給源として酸としての性質を示す。水分子の酸素原子上に孤立電子対があることから、水は塩基、配位子としてもはたらく。水分子を配位子とする錯体は水和物、もしくはアクア錯体と呼ばれる。酸と塩基の定義のうち、アレニウスによる定義は水溶液中を前提にしたものである。
水は、使い捨てカイロでの鉄粉の酸化、6-ナイロンの合成など、化学反応の触媒としても用いられることがある。また、酸や塩基などを触媒としてエステルやアミドなどの加水分解や、アルケンへの付加反応(水和反応)の基質となる。
生化学反応でも水は頻繁に現れる。光合成では水が4電子酸化を受けて酸素となる。
水の分布 [編集]

地球の表面の約71%は海水に覆われている。 (→海)
水循環のモデル図
|
地球上の水 [編集]
地球上には多くの水が存在しており、生物の生育や熱の循環に重要な役割を持っている。気象学や海洋学などの地球科学、生態学における大きな要因の一つである。水蒸気は最大の温室効果ガスでもある[7]。
その97%が海水として存在し、淡水は残り3%にすぎない。そのほとんどが氷河や氷山として存在している。
| 位置 | 淡水湖 | 河川水 | 地下水浅 | 地下水深 | 土壌水 | 氷河 | 大気 | 塩水湖 | 海洋 |
|---|---|---|---|---|---|---|---|---|---|
| 存在比 (%) | 0.009 | 0.0001 | 0.31 | 0.31 | 0.005 | 2.15 | 0.001 | 0.008 | 97.2 |
このなかで、淡水湖・河川水・地下水浅が、人間が直接に利用可能な水で、総量の1%未満である。飲料水として利用できるものはさらに少ない。
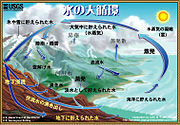
地球における継続的な水の循環は水循環と呼ばれている。太陽エネルギーを主因として、固相・液相・気相間で相互に状態を変化させながら、蒸発・降水・地表流・土壌への浸透などを経て、地球上を絶えず循環している。また、この循環の過程で地球表面の熱の移動や浸食・運搬・堆積などの地形を形成する作用が行われる。
太陽系の水 [編集]
太陽系の惑星および衛星の表面に存在する水のほとんどは氷または水蒸気であり、地球以外で液体の水が存在する場所は少ない。相図からわかるように、液体の水が存在できる温度範囲は高圧ほど広くなる。逆に、火星のように気圧の低い環境では、液体の水は安定に存在することはできない。
火星の表面にはかつて液体の水があったことが判明している。
木星の衛星エウロパは、内部に液体の水からなる海があるのではないかと言われている。
太陽系外の水 [編集]
2007年4月に発見された太陽系外惑星グリーゼ581cは、その質量と恒星からの距離のため、表面が地球のように岩山や海に覆われている可能性もある。
生物と水 [編集]

様々な生命が宿るサンゴ礁
|
すべての既知の生命体にとって、水は不可欠な物質である。
生物体を構成する物質で、最も多くを占めるのが水である。核や細胞質で最も多い物質でもあり、細胞内の物質代謝の媒体としても使用されている。通常、質量にして生物体の70% - 80%が水によって占められている。生きている細胞には(理想的な溶媒である)水が多く含まれており、生命現象を司る化学反応の場を提供し、また水そのものが種々の化学反応の基質となっている。体液として、体内の物質輸送や分泌物、粘膜に用いられ、また高分子鎖とゲル化することで体を支える構造体やレンズにも利用されている。クマムシのように厳しい環境にも耐えられる生物は、体内の水分を放出し、不活性な状態をつくり出すことができる。
なお、生物は太古の海で誕生したと考えられている。生物の化学組成と海水の組成がにていることもその根拠の一つである。従って、水中生活が生物の原始的な姿であると見てよい。
陸上のように、常に水につかっていない環境では、生物にとって最も重要な問題の一つが水の確保である。陸上の無脊椎動物では、周囲が湿っていなければ活動できないものも多い。陸上生物に見られる進化的形態の多くが水の確保や自由水のない環境への適応である。クマムシの場合も、頻繁に乾燥にさらされる環境への適応として、休眠の能力が発達したと考えられている。
特に人体においては、体重の60%を占める水のうち45%までが、細胞内に封じ込められた水で、残り15%が、血液、リンパ液など細胞の外にある水である。この細胞内液、細胞外液をあわせたものを体液と呼び、この体液が生命の維持、活動に重要な役割を果たす。
一日に排出される水の量は、静かに横たわっている成人男性で2,300mLであり、内訳としては尿1,200mL、糞200mL、不感蒸泄900mLである。1日に必要な水の量は当然2,300mLである。一般に、飲料水から1,200mL、食物800mL、代謝物300mLとして摂取される。なお、不感蒸泄とは呼気に含まれる水蒸気として体外に吐き出されたり、皮膚表面から感知できない程度に分泌される汗のことである。
水素結合による利点 [編集]
水分子間における水素結合を生物は様々な形で利用し、またその恩恵を受けている。
- 生体に不可欠な構成要素であるタンパク質が必要な立体構造を作る際(フォールディング)に、各アミノ酸同士にはたらく水分子を仲立ちとした水素結合が重要な役割を演ずる。
- 生物環境という立場から見れば、水はその(水素結合に起因する)比熱が大きいことによって温度を安定させる緩衝の意味合いが大きく、恒常性の維持に貢献していると言える。
- 低温の固体が液体より上部にくることは、海や湖沼を完全凍結しにくくし、生物に生存のチャンスを与えている。液体である4℃の状態で最も密度が大きくなるという性質は水素結合の性質に起因している。
- 汗は非常に効率よく体温を下げる機能をもつ。水の蒸発潜熱が大きいのは水素結合が強いことに起因している。
脱水症 [編集]
体内の水分量が不足した状態を医学的には脱水と呼ぶ。水分喪失量に対して水分摂取量が不足することによって起こる。水分摂取不足、あるいは水分喪失過剰、あるいは水分摂取不足と水分喪失過剰の同時進行によって起きる。具体的には、高温の環境、重作業、激しい運動、発熱、下痢、嘔吐などが原因となって起きる。
水中毒 [編集]
人体が過剰な水分を投与された場合、細胞外液の浸透圧が異常に下がり、低ナトリウム血症によって悪心、頭痛、間代性痙攣、意識障害等の症状を引き起こす。これを水中毒と言い、輸液ミス、心因性多飲、SIADHなどの結果としてみられる。なお致死量は体重65kgの人で10 - 30リットル/日である。
人間の生活と水 [編集]
世界のそれぞれの地域における水の状況は、地域による差が大きく、その地域の気候を決める重要な要素であり、それによってそこで生活する人間のあり方も大きく異なる。特に農業の形態は気候に大きく左右され、それはそこに成立する社会の構造をも決定する。
水の供給 [編集]
水の利用は都市生活の維持にとって重要なため、古代から一部の国では水道が建設された(上水道・下水道)。産業利用を目的とした水利は、用水路と呼ばれる(農業用水・工業用水)。
だが、現代でも途上国などでは水道が無い国が多く、毎日自力で長距離を歩いて重い水をバケツ等で家まで運ばなければならず、その労働のために学校へ行くことすらままならないという子供たちが多数存在している。
水の使用 [編集]
グローバルな使用状況 [編集]
世界の水の使用量は1995年の段階で年間約35,700億m³で、内訳としては、農業用水が約25,030億m³/年で約7割を占め最大、工業用水が約7,150億m³/年、生活用水が約3,540億m³/年だった、とも推定されている。水使用量は1950年から1995年までで2.6倍になっているともされ、2025年には30億人以上が水の量と質の限界(水ストレス)に直面する、とも予想されている[8]。仮想水という指標で水の使用量が計算されている。
家庭での水の使用状況と用途 [編集]
家庭での水の使用量は、国ごとに著しく異なる。途上国の中には一日一人あたり数リットルという国もある一方で、先進国では一日一人あたり数百リットル、という差がある。日本の家庭の使用量も他の先進諸国と同様、最も高い部類に属する[9]。
日本での使用状況の一例として東京の家庭でのそれを挙げると、1日で1人あたり242Lの水を使っている(2005年現在、東京都水道局調べ)。家庭での水の使用量のうち、28%がトイレ、24%が風呂、23%が炊事、17%が洗濯となっている(2002年、東京都水道局調べ)[10]。
その他の水の用途 [編集]

スイミングをする少女
|
- 生体摂取 - 生物(細胞)の活動に必須。植物は根などから吸収。動物は直接飲用、または食物より摂取
- 熱交換 - エンジン・エアコンの水冷式、ラジエーター、冷却水、打ち水
- 温度の利用 - 入浴・温泉、サウナ、床暖房装置、かき氷、かち割り
- 浮力の利用 - 船舶、水泳
- 溶媒としての利用 - 水割り、点滴、洗濯 - 超純水
- 特異な相転移の利用 - スキー、スケート
- 位置エネルギーの利用 - 水力発電、水車、波力発電、ししおどし
- 水蒸気(スチーム)の圧力の利用 - 蒸気機関、火力発電、原子力発電
- 消火剤 - 消火栓、消防用水
- 物理学実験 - スーパーカミオカンデなど(ニュートリノ検出のために超純水を活用。カミオカンデの項に原理の解説あり)
水についての考察・研究史 [編集]
古代 [編集]
古代ギリシアの哲学者タレスは、万物の根源アルケーを探求する中で、アルケーは水であると考えた。
同じく古代ギリシャのエンペドクレスは、すべての物質は水、空気、土、火の4つのリゾーマタから構成される、とする、いわゆる「四元素説」を唱えた。これはアリストテレスに継承された。
中国においても、万物は木・火・土・金・水の5種類の元素から成るとする「五行説」が唱えられた。
近代以降の水(氷)の研究史(主要なもの) [編集]
- 17世紀初頭 ベルギーのファン・ヘルモントは植物成長に関する実験により、水を元素と結論づけた。あらかじめ重量を測定した鉢植えに水だけを与え、4年後に重量を測定すると重量が増加していた。すなわち水元素が木元素に変換したことになる。ヘルモントはガスという用語を作り出している。ビールの発酵、石炭の燃焼、炭酸塩から発生するガスが全て同じものであり、命名もしていたが、彼自身の実験と彼のガスの関係には気づいていなかった。
- 1765年 イギリスのキャベンディッシュ、水を材料に熱の研究を行ない、蒸発熱や潜熱を測定している。
- 1766年 キャベンディッシュ、「人工空気の実験を含む三論文」を発表。第一論文で「可燃性空気」すなわち水素の発見を発表。ただし、水素の燃焼物が何であるかを理解していなかった。
- 1781年 酸素の発見者の一人イギリスのプリーストリーは水素の燃焼物が水であることを見いだし、キャベンディッシュに確認を求める。
- 1784年 キャベンディッシュが「空気に関する諸実験」を発表。水の組成を確認する実験について記述されている。実験には2年を要した。水素と酸素を電気火花によって反応させると大量の反応熱を出すため、生成物にどうしても窒素の酸化物である硝酸が混入してしまうためであった。彼の論文では水素と酸素を可燃性空気と脱フロギストン空気としているものの、水素2容積と酸素1容積から水が生成することを確認している。フロギストンによらない説明を最初に与えたのは酸素という名を命名したラボアジェであった。
- 1785年 ラボアジェが赤熱した鉄管に水を通すと水素が発生することを示し、水素、酸素こそが元素であって、水は化合物であることを最終的に確認した。
- 1791年 イタリアのボルタが酸素と水素が一定の比率で化合する性質を利用し、逆にこれらの気体の分量を測定するユージオメーターを開発した。
- 1800年 ボルタ、化学反応による電流の発生に成功。「ボルタの電堆」と呼ばれる(電池)。
- 1801年 イギリスのウィリアム・ニコルソン、「ボルタの電堆」を用いて、初めて水を電気分解した。陰極に水素が2容積、陽極に酸素が1容積発生することを示した。
- 1920年 この頃までに水素結合の概念が提唱される。
- 1933年 バナールが、水のX線構造解析を行う。
- 1935年 ポーリング、氷の残余エントロピーの理論。
- 1936年 中谷宇吉郎、雪の結晶を人工的に世界で初めて作成する。
- 1958年 アイゲン、水中のプロトン移動に関するモデルを提唱する。
- 1971年 ラーマンにより、水の分子動力学法によるシミュレーションが行われる。
- 1971年 ペイジが、水の中性子による構造解析を行う。
- 1994年 三島修が、 2 つのアモルファス氷の間(低密度⇔高密度)の一次相転移を発見。
- 2005年 R. J. D. Miller らにより、水にレーザーパルス照射で生じさせた構造変化は 50 フェムト秒以内に失われることが報告された[11]。
水と芸術 [編集]
水は人類にとって最も身近で重要なものであり、かつ様々な態様を見せることから、水をモチーフとした数々の芸術作品が生み出されている。 水そのものを取り入れたものに庭園における池や噴水がある。
文学 [編集]
- 『雪のひとひら』 ポール・ギャリコ
- 『水妖記 ウンディーネ』 フリードリヒ・フーケ
美術 [編集]
- 『春』 サンドロ・ボッティチェッリ
- 『水』 ジュゼッペ・アルチンボルド
- 『イカロスの墜落のある風景』 ピーテル・ブリューゲル
- 『神奈川沖浪裏』 葛飾北斎
- 『泉』 ドミニク・アングル
- 『大はしあたけの夕立』 歌川広重
- 『波』 ギュスターヴ・クールベ
- 『オフィーリア』 ジョン・エヴァレット・ミレイ
- 『ナイアガラ瀑布』 フレデリック・チャーチ (Frederic Edwin Church)
- 『睡蓮』 クロード・モネ
- 『Clyties of the Mist』 ハーバート・ドレイパー (Herbert James Draper)
- 『雨』 ディヴィッド・ホックニー
音楽 [編集]
- 「伊勢海」 雅楽催馬楽
- 「青海波」 雅楽
- 「玉川」 地歌手事もの曲。国山勾当作曲
- 「水の変態」 箏曲。宮城道雄作曲
- 「瀬音」 箏十七弦箏二重奏曲。 宮城道雄作曲
- 「ロンドンの夜の雨」 箏独奏曲。宮城道雄作曲
- 「五十鈴川」 箏独奏曲。 宮城道雄作曲
- 「春の海」 尺八箏二重奏曲。宮城道雄作曲
- 「泉」 尺八箏二重奏曲。宮城道雄作曲
- 「水上の音楽」 ヘンデル
- 「小川のほとりの情景」 ベートーヴェンの交響曲 第6番「田園」第2楽章
- 「小川」 フェリックス・メンデルスゾーンの無言歌集 第2巻 第5曲
- 「雨だれの前奏曲」 ショパンの「24の前奏曲」第15曲
- 「エステ荘の噴水」 フランツ・リスト
- 「水の上を歩くパオラの聖フランチェスコ」 フランツ・リストの「二つの伝説」第2曲
- 「モルダウ」 ベドルジハ・スメタナの連作交響詩「わが祖国」から
- 「美しき青きドナウ」 ヨハン・シュトラウス2世
- 「水に映る影」 フォーレの歌曲集「幻影」第2曲
- 交響詩「海」 クロード・ドビュッシー
- 「水の反映」 クロード・ドビュッシー: 映像第一集の中の曲
- 「雨の庭」 クロード・ドビュッシーの「版画」第3曲
- 「滝」 リヒャルト・シュトラウスの「アルプス交響曲」から
- 「水の戯れ」 モーリス・ラヴェル
- 「ローマの噴水」 オットリーノ・レスピーギ
- 「AQUA FEEL AQUA SOUL」 AQUA5
別称 [編集]
- IUPAC系統名はオキシダン (oxidane) であるがほとんど用いられない。(→記事「水素化物」参照)。ほか、「一酸化二水素」「酸化水素」「水酸」「水酸化水素」といった呼び方をすることも可能である。
- うち、「一酸化二水素」は英訳されて「Dihydrogen Monoxide」(ジハイドロジェン・モノオキサイド)ならびにその略称「DHMO」と言う表現をされる事もある。
- 水をネタに、感情的な環境保護論を揶揄するジョークがある。記事「DHMO」(Dihydrogen Monoxide) を参照。
代表的な慣用句 [編集]
- 水掛け論 - 田に水がほしい双方が水を掛け合ってまで争うところからきているといわれる
- 湯水のように(ごとく) - 日本ではかつて「水と安全はタダ」など言われ、水は非常に安価または無料の代名詞であったため、躊躇なく使うことを言い,通常は無駄遣いや乱費の表現として用いられる。
- 水商売または、お水 - 飲食業、あるいは風俗業の別称。一日の客数が安定しない(水物)から、もしくは酒の水割り用の水道水に値段を付ける(金を取る)ことから。
- 水に流す - 汚れ物は水に溶かして流れさるに任せるのが古来の流儀である。実際に多くの汚物は水中における自然の浄化作用とその人工的応用である汚水処理によって処理される。
他にも、世間や市場に飛び交うもの(貨幣や情報など)を水にたとえて、「洪水のような」とか「氾濫する」とかいう表現がされることがある。
参考文献と脚注 [編集]
| [ヘルプ] |
- ^ 英語では、温度が高い場合でも、名詞は一定で、あくまで別に、形容詞を付加する。「hot water」
- ^ 特に温度の高いものは熱湯(ねっとう)と言う(理・工学的な分野では熱水(ねっすい)という語も用いられる)。アイヌ語では、低温の水のことをワッカ、高温の水のことをウセイという。
- ^ a b Vienna Standard Mean Ocean Water (VSMOW), used for calibration, melts at 273.1500089(10) K (0.000089(10) ℃, and boils at 373.1339 K (99.9839℃)
- ^ 特定の物質を出発点にして質量の基準を定めようとすると、純度、体積 (=寸法3)、圧力、温度が関わってくるので、これらを同時に高精度に維持しつつ質量を決定することは、水に限らずどのような物質であろうが容易ではない。なお、ケイ素は不純物が非常に少ない単結晶を作りやすいため、次世代の質量の基準となる物質として候補にあげられているが、やはり体積、温度の精度も上げる必要があり、アボガドロ定数と組み合わせるなどの工夫も考えられている。
- ^ 質量は国際キログラム原器によって定義されたが、これから逆に物質の密度を高精度に求めようとすると、その物質の純度や、体積、圧力、温度などの精度が関わってくるので、質量の基準を求めるときと全く同じ理由によりやはり容易ではない。
- ^ O. Mishima, L. D. Calvert, and E. Whalley, Nature 310, 393 (1984).
- ^ Kielh, J. T.; Trenberth, K. E. (1997). "Earth's annual global mean energy budgetPDF." Bull. Am. Meteorol. Soc. 78: 197 - 298 によると、温室効果のうち60%が水蒸気に由来する。第2位が二酸化炭素 (26%) である。
- ^ 「世界の水危機と第三回世界水フォーラム」PDFp.12 「世界の水利用」
- ^ 関連資料。
- INAXニュースリリース『日本人は、一人一日に1,460リットルの水を輸入していることを知っていますか?「ヴァーチャルウォーター(仮想水)」という考え方』
- 大阪ガス「生活者ができる地球温暖化防止のために」PDF
- 三宅基文、沖大幹、虫明功臣 「日本を中心とした仮想水の輸出入」( 第 6 回水資源に関するシンポジウム論文集, 2002)MS Word文書。
- AQUASTAT, FAO 2005, 「Water availability information by country」
- ^ 東京都水道局
- ^ Cowan, M. L.; Bruner, B. D.; Huse, N; Dwyer, J. R.; Chugh, B.; Nibbering, E. T. J.; Elsaesser, T.; Miller, R. J. D. Nature 2005, 434, 199-202. DOI: 10.1038/nature03383
関連項目 [編集]
- 海 - 海洋深層水
- 川 - 滝
- 湖 - 池 - 水たまり - オアシス
- 雨
- 地下水 - 井戸
- 水道 - 上水道 - 中水道 - 下水道
- 水質汚濁 - 地下水汚染 - 公害
- 水の危機 - 世界水会議、世界水フォーラム、アジア太平洋水サミット
- 仮想水
- ウォータースポーツ、潜水、水泳、古式泳法
- 打ち水
- ウォーターカッター
- 水筒
- 水分
- 水面
- 水毒
- セルシウス度
- 純水、超純水、軽水、重水
- 水蒸気、過冷却水、氷
- 硬水 - 軟水 - ミネラルウォーター
- 機能水
- ポリウォーター
- DHMO
- ムペンバ効果
- 電気双極子
外部リンク [編集]
- 環境省水環境関係
- 国土交通省水資源
- 「Physical properties of water」 - Encyclopedia of Earth にある「水の物理的性質」についての項目(英語)。
- The Water Cycle:USGS米国地質調査所の水循環のページ。日本語訳あり。
個人用ツール
他の言語
-
Afrikaans Alemannisch አማርኛ Aragonés Ænglisc العربية ܐܪܡܝܐ مصرى Asturianu Aymar aru Azərbaycanca Башҡорт Boarisch Žemaitėška Беларуская Беларуская (тарашкевіца) Български भोजपुरी Bahasa Banjar Bamanankan বাংলা Brezhoneg Bosanski Català Mìng-dĕ̤ng-ngṳ̄ Нохчийн Cebuano Chamoru ᏣᎳᎩ Soranî / کوردی Corsu Nēhiyawēwin / ᓀᐦᐃᔭᐍᐏᐣ Česky Чӑвашла Cymraeg Dansk Deutsch ދިވެހިބަސް Ελληνικά Emiliàn e rumagnòl English
- Esperanto Español Eesti
- Euskara Estremeñu فارسی Suomi Võro Français Furlan Frysk Gaeilge 贛語 Gàidhlig Galego Avañe'ẽ ગુજરાતી Gaelg Hak-kâ-fa
- עברית हिन्दी Fiji Hindi Hrvatski Hornjoserbsce Kreyòl ayisyen Magyar Հայերեն Interlingua Bahasa Indonesia Interlingue Ido Íslenska
- Italiano Lojban Basa Jawa ქართული Taqbaylit Kongo Gĩkũyũ ಕನ್ನಡ 한국어 Ripoarisch Kurdî Latina Ladino Lëtzebuergesch Limburgs Lumbaart Lingála Lietuvių Latviešu Malagasy
- Македонски മലയാളം Монгол मराठी Bahasa Melayu Mirandés မြန်မာဘာသာ مازِرونی Nāhuatl Plattdüütsch Nedersaksisch नेपाली नेपाल भाषा Nederlands Norsk (nynorsk) Norsk (bokmål) Nouormand Diné bizaad Occitan Oromoo Иронау ਪੰਜਾਬੀ Papiamentu Deitsch Polski پنجابی Português Runa Simi Română Русский Kinyarwanda Саха тыла Sardu Sicilianu Scots Srpskohrvatski / Српскохрватски සිංහල Simple English Slovenčina Slovenščina Soomaaliga Shqip Српски / Srpski Basa Sunda Svenska Kiswahili Ślůnski தமிழ் తెలుగు Тоҷикӣ ไทย Tagalog Türkçe Татарча/Tatarça Українська اردو O'zbek Vèneto Tiếng Việt West-Vlams Volapük Winaray Wolof 吴语 ייִדיש Yorùbá Vahcuengh 中文 文言 Bân-lâm-gú 粵語 isiZulu










初めまして。
水道局のリンクが破損されております。有効なリンクに変えていただければアップデートできるかと存じます。
破損されたリンク:http://www.waterworks.metro.tokyo.jp/pp/syuukan/s02.htm
有効なリンク:https://selectra.jp/hikkoshi/water/tokyo
宜しくお願い致します。
投稿情報: なーさん | 2021年11 月 4日 (木曜日) 15時31分